COVID19: Origen, tendencias actuales y escenarios para Guatemala
COVID19: Origen, tendencias actuales y escenarios para Guatemala
- Tres científicos (dos de la Universidad de Florida y uno de la Universidad de San Carlos) repasan el origen del COVID19, descartan que sea una creación de laboratorio, examinan tendencias mundiales y latinoamericanas, y elaboran proyecciones y escenarios sobre el ritmo de contagios y las muertes en Guatemala.
- Sus proyecciones, ajustadas hasta hoy, les permiten proyectar 784 casos a fin de mes, si no se toman medidas ahora.
- No mañana, ni pasado mañana, ni el fin de semana. Hoy.
- Sin intervención, proyectan 220 muertes en San Pedro Sacatepéquez en dos años, 11,000 en el departamento de Guatemala y 29,000 en las áreas urbanas de todo el país.
- Con un esfuerzo colectivo de mitigación, las muertes decaen a 125 en San Pedro Sacatepéquez, 2,000 en el departamento de Guatemala y 2,500 en las regiones urbanas del país.
- Las proyecciones no toman en cuenta el posible influjo de la estacionalidad de la transmisión y se basan en resultados de otros sistemas de salud más sólidos.
- Independientemente de la precisión de estas proyecciones, detener el avance del COVID19 requiere que seamos proactivos.
Tres científicos (dos de la Universidad de Florida y uno de la Universidad de San Carlos) repasan el origen del COVID19, descartan que sea una creación de laboratorio, examinan tendencias mundiales y latinoamericanas, y elaboran proyecciones y escenarios sobre el ritmo de contagios y las muertes en Guatemala.
Origen
A principios de diciembre de 2019 se registró en la ciudad de Wuhan, China, un nuevo síndrome respiratorio agudo en humanos causado por un virus hasta entonces desconocido, ahora identificado como el coronavirus SARS-CoV-2. Los coronavirus pertenecen a una familia de virus comunes en humanos y en varias especies de animales.
No es frecuente que un coronavirus de origen animal afecte a las personas. Sin embargo, ha ocurrido ocasionalmente. Tales eventos son denominados por los epidemiólogos como transferencias horizontales o "derrames" de una población animal a la población humana.
Dos ejemplos recientes muy conocidos hicieron entender a los expertos que, a diferencia de lo que pasaba en la Antigüedad, hoy en día un evento de transferencia horizontal no permanece localizado y puede propagarse de un rincón del planeta al otro en cuestión de días.
[relacionadapzp1]
El MERS-CoV responsable del Middle East Respiratory Syndrome descubierto en 2012, endémico en camellos, causó más de 2,000 infecciones y 700 muertes (OMS, 2017). El virus evolucionó exclusivamente en camellos. Sin embargo, los eventos de transferencia horizontal a humanos estuvieron asociados a la época de parición de los camellos. Pese a que el virus tenía una pobre transmisión entre humanos, un alto porcentaje de casos fueron ocasionados por microepidemias nosocomiales (Doudas et al., 2019; Fabgo el al., 2015).
Otro caso fue el brote del virus del SARS en 2002 y 2003, encontrado inicialmente en ginetas. Un estudio comparativo entre ginetas salvajes y de criadero demostró que estos animales son hospederos secundarios y que el hospedero original es un murciélago de género Rhinolophus. Posteriormente, muchos coronavirus relacionados con el SARS-CoV fueron descubiertos en diferentes provincias de China, en países europeos, africanos y del sureste de Asia. En total, el SARS-CoV afectó a más de dos docenas de países y causó una verdadera emergencia en salud pública antes de ser contenido.
[frasepzp1]
La pandemia del CoViD-19 tiene un origen similar. A nivel genómico, un estudio de las primeras 27 secuencias de ADN del virus responsable del CoViD-19 muestra su parentesco inequívoco con virus de murciélagos. Este análisis ha servido para descartar las diferentes hipótesis del origen. En particular, la teoría sobre un origen sintético, de laboratorio, ha quedado plenamente desechada (A. Cheepsattayakorn and R. Cheepsattayakorn, 2020).
Tendencias
El SARS-CoV-2 ha mostrado propagarse con facilidad en las poblaciones. El primer foco de infección fue localizado en el mercado de carne de animales salvajes de Huanan, China, a principios de diciembre. Tres meses después el virus se ha diseminado en 160 países afectando a más de 240,000 personas, de las cuales han fallecido alrededor de 10,000.
Hasta ahora, la tendencia del número de casos confirmados en tiempo real para cada país ha sido reportada con error por la siguiente razón: en una epidemia de rápida expansión, como el CoViD-19, el grado de subregistro es considerable. Durante la etapa inicial del brote en una localidad, el ritmo de casos reportados subestima al ritmo real de casos de contagio. Esto debido a que no todos los enfermos se reportan y, en general, los centros de salud no cuentan con suficientes kits de pruebas para confirmar la presencia del virus. Sin embargo, hay países como Corea del Sur que, tras confirmar los primeros casos, iniciaron una producción masiva de kits de prueba y con esto lograron atajar el avance acelerado de la epidemia.
Aunque contengan error, examinar las tendencias en tiempo real de los casos confirmados es útil para tomar medidas de control del riesgo porque el crecimiento del número de casos en el tiempo contiene información sobre los procesos que lo rigen. En las epidemias, un individuo infeccioso causa un número promedio de infecciones secundarias durante el tiempo de infecciosidad. Cada enfermedad contagiosa se caracteriza por el número promedio de infecciones secundarias que un solo individuo infectado causa cuando llega a una población sana. Esta cantidad se conoce como el número de reproducción básico, denotado R0 por los científicos y es un indicador de la invasividad de la epidemia. Si R0 es mayor que uno la enfermedad se propaga. Mientras que si es menor que uno, el número de infecciones secundarias no es lo suficientemente alto para sostener la epidemia. En la medida que se aleja de uno por valores mayores, la severidad de la epidemia aumenta. Para el CoViD-19, los epidemiólogos chinos han estimado el valor de R0 entre dos y tres, lo que coloca a esta epidemia entre las más severas de la historia reciente.
[relacionadapzp2]
La etapa inicial de la epidemia, cuando los casos se acumulan de manera multiplicativa, se puede conceptualizar de manera muy sencilla. Suponga que el número de casos día a día incrementa por un factor f. Si f=0.36, el número de casos incrementará un 36%. Así el número de casos de mañana será igual al número de casos de hoy más el 36% de este número. En otras palabras
# casos mañana = # casos hoy + 0.36 *(# casos hoy) = # casos hoy *(1 + 0.36).
En general, la cifra F= (1+f), que en este caso es 1.36, se conoce como la tasa finita de crecimiento geométrico. Si esta tasa es mayor que uno, el número de casos aumentará y, si es menor que uno, el número de casos decaerá hasta alcanzar 0. Esta tasa entonces cumple un rol análogo al R0 porque puede servir tanto como un indicador temprano de la intensidad de la acumulación de casos, como una herramienta para comparar la progresión de la epidemia en diferentes localidades.
[frasepzp2]
En la figura 1 se muestra un ajuste de crecimiento geométrico para 20 días de la etapa temprana de la epidemia en cinco países y Latinoamérica. Para todas las localidades, la tasa finita de crecimiento es mayor que uno. La más pequeña ocurre en Corea del Sur y la mayor en España. Latinoamérica presenta una tasa de crecimiento similar a la de Italia. La línea horizontal roja en cada gráfica marca el número de casos confirmados al 16 de marzo para Latinoamérica para efectos comparativos. Para los casos de China, Corea del Sur, Italia y España es posible obtener un mejor ajuste suponiendo que en algún momento durante esos 20 días ocurre una baja en la tasa de crecimiento. Este cambio puede muy bien reflejar medidas de intervención de los gobiernos de estos países. De hecho, en algunos casos el cambio es tal que tras la transición, el crecimiento parece ser aditivo (lineal) y no multiplicativo. Nótese sin embargo que para el caso de Estados Unidos y Latinoamérica el modelo geométrico se ajusta muy bien incluso hasta los días más recientes. Para Estados Unidos, este fenómeno puede no ser más que una indicación de que allí no se efectuaron suficientes pruebas, ni se distribuyeron kits de manera masiva para detectar al virus y contener su crecimiento de manera temprana.
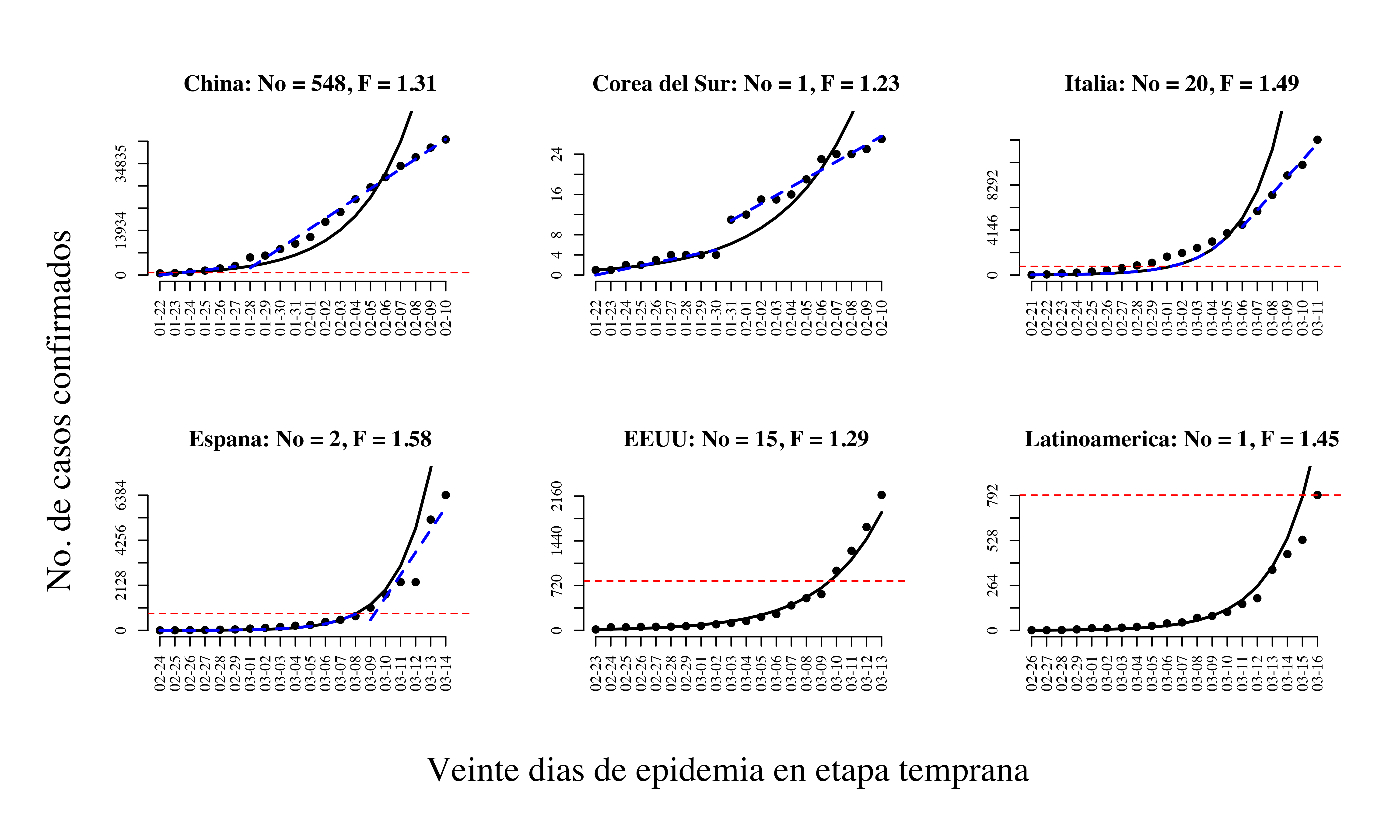
En Latinoamérica, la bondad de este ajuste geométrico refleja una falta de medidas de control suficientemente extensas hasta la fecha. Las curvas descritas también pueden usarse para hacer proyecciones de qué se esperaría si no se toman medidas ahora en Guatemala. No mañana, ni pasado mañana, ni el fin de semana. Hoy. De hecho, la tasa finita de crecimiento para Latinoamérica calculada con datos hasta el 16 de marzo predice muy bien el número de casos confirmados al día de hoy, 19 de marzo en Guatemala: 9.22 versus 9 casos observados. De continuar con el mismo ritmo, a fin de mes se proyectan aproximadamente 784 casos.
Modelo matemático formal y escenarios para la población de Guatemala
Un modelo matemático formal simple puede usarse para contestar preguntas básicas útiles para dirigir los esfuerzos de control y manejo de la epidemia.
¿Alrededor de cuántas personas se infectarán? ¿Cuánto durará la epidemia? ¿Cuándo se frenará el brote? ¿Están funcionando las medidas de mitigación o supresión? Estas son algunas preguntas necesarias para los tomadores de decisiones.
Los modelos matemáticos epidemiológicos intentan capturar la esencia del problema. No dejan de ser visiones simplificadas de la realidad pero suelen ser útiles para revelar la dinámica del contagio. Hay que tener en cuenta que la utilidad de un modelo está sujeta a la calidad de los datos y a cuán acertadas sean las hipótesis que lo justifican. Un estudio completo requiere un análisis de sensibilidad e incertidumbre que aquí no incluimos.
Bajo estas consideraciones, hicimos el ejercicio de establecer dos escenarios para el país: el primero sin intervención y el segundo agregando un factor de mitigación de la tasa de contagio que mejora con el tiempo. Este tipo de intervención podría representar, por ejemplo, un esfuerzo de distanciamiento social cuya efectividad mejora a medida que la población se concientiza.
El modelo en cuestión divide a las personas de la población en estudio en cinco categorías:
1) susceptibles de contraer la infección
2) expuestas al virus que no necesariamente se infectan o que pueden ser asintomáticas
3) infectadas
4) recuperadas, y
5) fallecidas.
El modelo se alimenta de parámetros que caracterizan a la epidemia tales como la tasa de contagio y la tasa de mortalidad. Si bien el comportamiento de la epidemia puede variar de una población a otra por diferencias demográficas o comportamientos sociales, la información del brote del CoViD-19 en China es lo suficientemente útil para tener una caracterización aproximada del fenómeno epidémico.
Con estos datos se ha estimado que el periodo de incubación es en promedio de 5.2 días, el periodo de recuperación de pacientes entre 8 y 17 días y una tasa de mortalidad de 2.8 % (Wang et al, 2020).
Ambos escenarios se muestran en la figura 2, para el municipio de San Pedro Sacatepéquez, el departamento de Guatemala y las regiones urbanas del país. Los datos poblaciones se recabaron de los resultados del censo del 2018. Las proyecciones sin intervención se muestran en rojo, y con intervención en azul. Sin intervención, el total de muertes ocasionadas por la enfermedad en dos años se proyecta a 220 en San Pedro Sacatepéquez, 11,000 en el departamento de Guatemala y 29,000 en las áreas urbanas de todo el país. Las proyecciones no toman en cuenta el posible influjo de la estacionalidad de la transmisión.
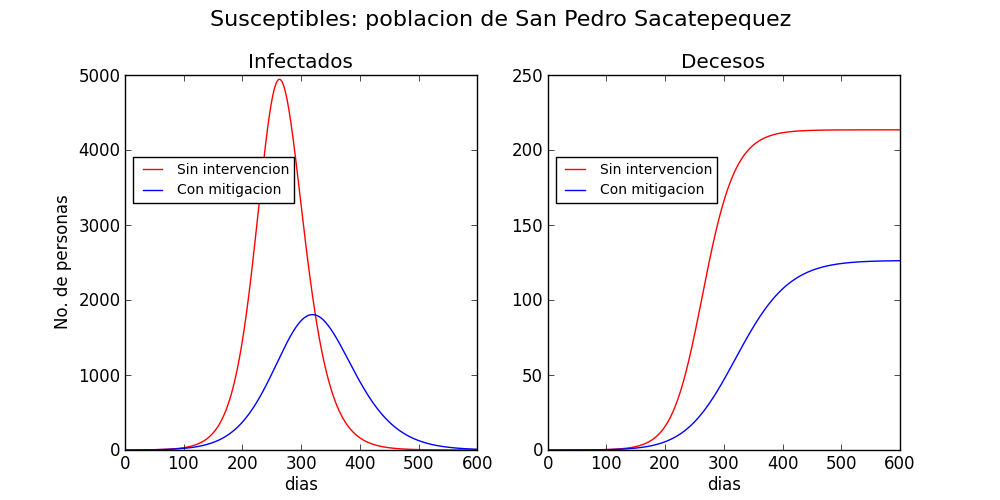
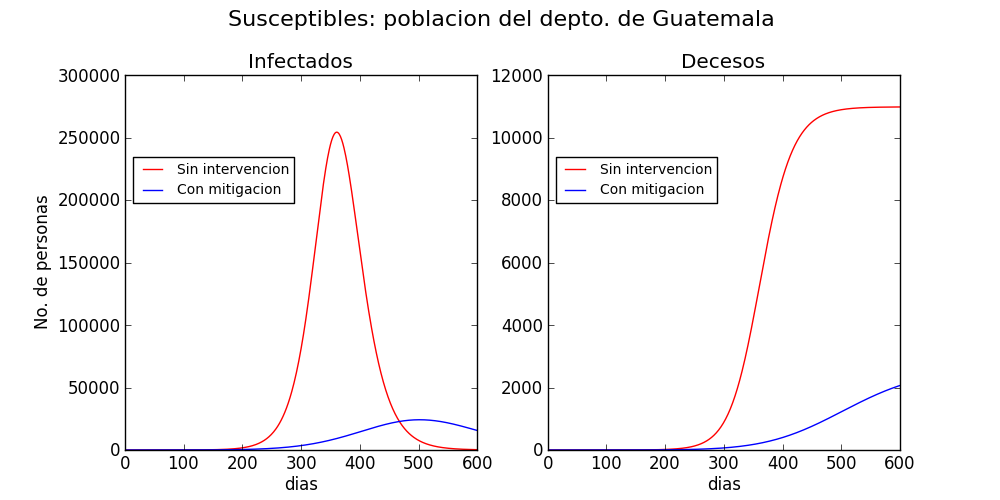
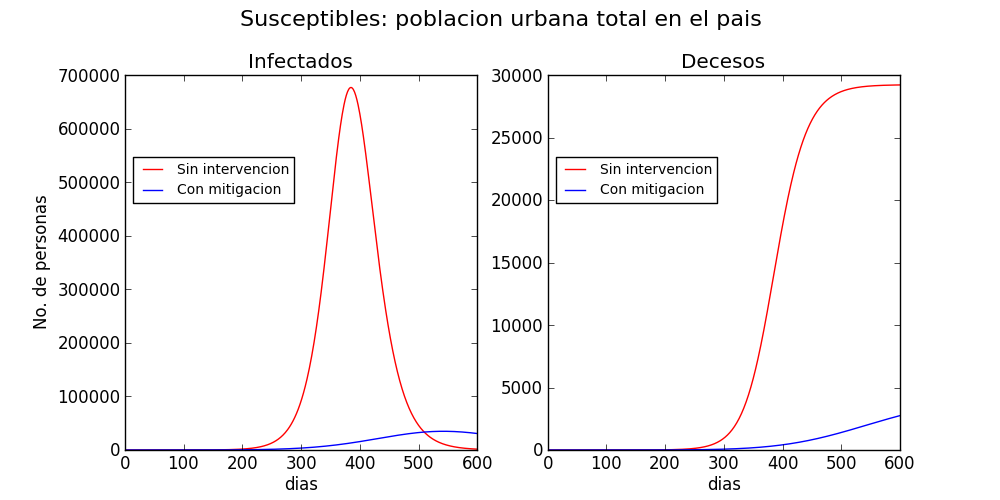
En contraste, cuando se realiza un esfuerzo colectivo de mitigación, las muertes decaen a 125 en San Pedro Sacatepéquez, 2,000 en el departamento de Guatemala y 2,500 en las regiones urbanas del país.
Tiene que tomarse en cuenta que estas proyecciones fueron calculadas con parámetros estimados en países con sistemas de salud sólidos, a diferencia de Guatemala y que la tasa de mortalidad que usamos por lo tanto es conservadora. Independientemente de la precisión de estas proyecciones, detener el avance del CoViD-19 requiere que seamos proactivos.
Finalmente, para prevenir enfermedades emergentes, urge reconocer que hay un vínculo muy estrecho entre los humanos, la biodiversidad global y nuestros ecosistemas. El 60% de las enfermedades infecciosas en humanos son zoonóticas. Es decir, se transmiten de animales domésticos y silvestres a humanos. La globalización, el crecimiento demográfico, el comercio, el cambio climático, los cambios de uso de terreno y deforestación, son algunos de los factores que están asociados al incremento de estas enfermedades.
Para poder entender la vida silvestre, conocer qué patógenos rondan comúnmente y cuál sería su potencial de causar enfermedades en humanos, urge asignar fondos para la investigación científica.
Urge, igualmente, promover la conservación del ambiente y disminuir los efectos del cambio climático, pues la degradación ambiental y el impacto de los cambios en el clima podrían contribuir a que surjan más infecciones emergentes o que éstas se transmitan más rápidamente. Los datos que tenemos hasta el momento sobre la pandemia del COVID-19 deberían de ser lo suficientemente aleccionadores para que todos cobremos conciencia de que el bienestar de uno es el bienestar de todos.































Más de este autor